Cap 16 Funções Inorgânica {Sais}
Nomenclatura dos sais
Nomenclatura geral
No geral, um sal é nomeado da seguinte maneira:
____________ de ____________
nome do ânion nome do cátion
Regra geral
A nomenclatura de um sal está relacionada com a nomenclatura do ácido que o originou
____________________________________
|SUFIXO DO ÁCIDO SUFIXO DO SAL|
| ídrico eto |
| ico ato |
| oso ito |
---------------------------------------------------
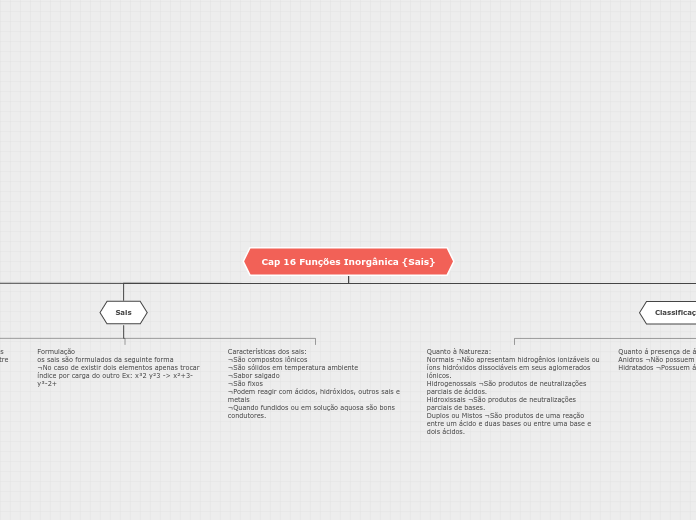
Classificação dos Sais
Quanto à solubilidade
Há variação entre os níveis de solubilidade em água
Sendo assim eles classificados como ¬Solúveis, Parcialmente solúveis e Insolúveis.
Quanto á presença de água no retículo cristalino
Anidros ¬Não possuem água no retículo
Hidratados ¬Possuem água no retículo
Quanto à Natureza:
Normais ¬Não apresentam hidrogênios ionizáveis ou íons hidróxidos dissociáveis em seus aglomerados iónicos.
Hidrogenossais ¬São produtos de neutralizações parciais de ácidos.
Hidroxissais ¬São produtos de neutralizações parciais de bases.
Duplos ou Mistos ¬São produtos de uma reação entre um ácido e duas bases ou entre uma base e dois ácidos.
Sais
Características dos sais:
¬São compostos iônicos
¬São sólidos em temperatura ambiente
¬Sabor salgado
¬São fixos
¬Podem reagir com ácidos, hidróxidos, outros sais e metais
¬Quando fundidos ou em solução aquosa são bons condutores.
Formulação
os sais são formulados da seguinte forma
¬No caso de existir dois elementos apenas trocar índice por carga do outro Ex: x³2 y²3 -> x²+3- y³-2+
De acordo com Arrhenius os sais são compostos obtidos junto à água no processo de reação entre ácido-base.
Ex: HCl + NaOH -> NaCl + H²O
Reações de Neutralização
As reações de neutralização ocorrem entre um ácido e uma base.
Os ions espectadores são aqueles que permanecem dissociados no final do processo de reação.
Segundo Arrhenius, um ácido reage com uma base formando sal e água, segundo Bronsted Lowry um ácido reage com uma base produzindo acido e base conjugado, já segundo Lewis a reação de um ácido e uma base leva a um composto de coordenação.
O produto mais importante para a neutralização é o sal por isso o termo salificação
Ao dissolver um ácido de Arrhenius na água se têm a formação de H+ e OH- que se unem formando a água
Ex: H+ + OH- -> H²O