jonka PLAY ff 3 vuotta sitten
214
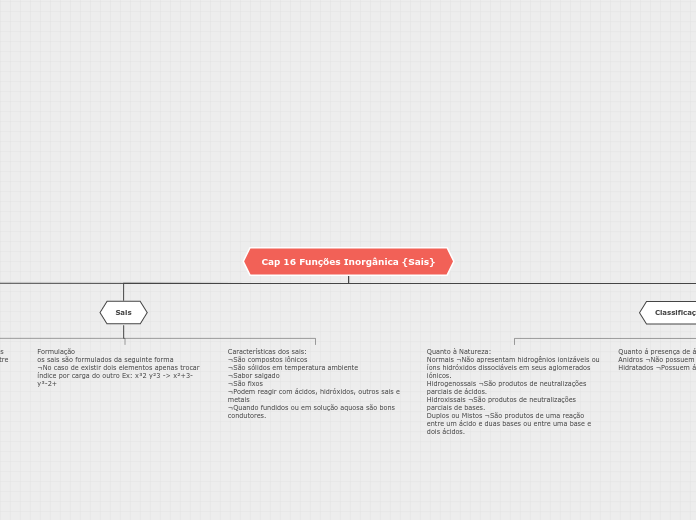
Cap 16 Funções Inorgânica {Sais}
Sais inorgânicos são classificados de acordo com a presença de água no retículo cristalino, podendo ser anidros ou hidratados, e pela sua natureza, como normais, hidrogenossais, hidroxissais, ou duplos/