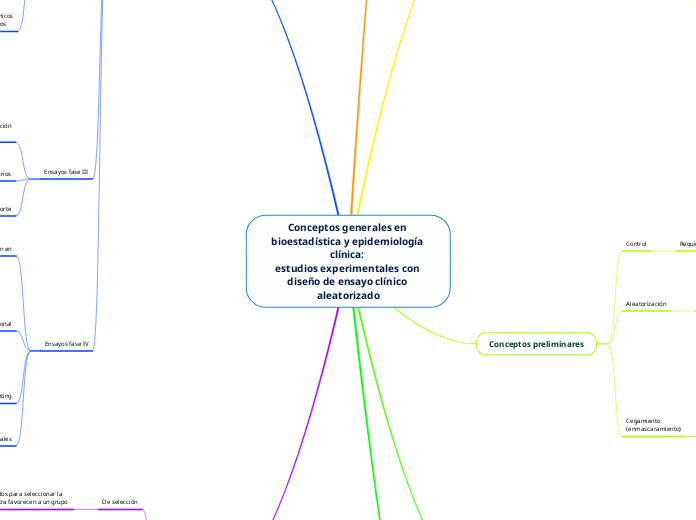
Conceptos generales en bioestadística y epidemiología clínica:
estudios experimentales con diseño de ensayo clínico
aleatorizado
De reporte
(reporting bias)
Se evalua mediante la revisión del
registro inicial del ensayo clínico
De desgaste o
post aleatorización
(attrition bias)
diferencias sistemáticas
en el seguimiento
De detección o
información
desenlace en estudio es
“detectado” entre los grupos
De desarrollo
(performance bias)
Seguimiento estricto de los pacientes
asignados a la intervención
métodos para seleccionar la
muestra favorecen a un grupo
Clasificación de
Ensayos Clínicos
Ensayos fase IV
Estudios observacionales
Estudios de cohorte
Casos y controles
Series de casos
Postmarketing
Información adicional
Interacciones farmacológicas
Farmacovigilancia
Nuevos usos
Beneficios
Efectos adversos
Riesgos
Evaluación en
Distintas poblaciones
Ensayos fase III
Soporte
Comercialización del fármaco
Autorización del registro
Estudios pivotales/confirmatorios
Estimación del tamaño muestral
Asociado
Hipótesis
Estudio de confirmación
terapéutica
Muestra
>300 participantes
Multicentrico
Ensayos fase II
Ensayos clínicos
aleatorizados
Fase II tardía
IIb
Superioridad vs
otros fármacos
Garantiza
Seguridad del
fármaco
Fase II temprana
IIa
Estudio piloto
Evalúa
Biodisponibilidad
Perfil de seguridad
100-300 participantes
Primera exploración clínica
del tratamiento
Se realizan
Con grupo control
Opcional
Pacientes portadores
Enfermedad
Aportan
Información preliminar
Seguriada clínica
Eficacia
Define
Posología
Ensayos fase I
Primeras pruebas en humanos
Estudios farmacológicos
(sin objetivo terapéuticos)
Abiertos no controlados
>100 pacientes
Se realizan en
Pacientes con enfermedad
Sin otra posibilidad
de tratamiento
Evalúan
Respuesta a distintas dosis
dosis máxima segura
Tolerancia
Parametros
farmacodinámicos
Parametros
farmacocinéticos
Toxicidad
Estudios preclínicos
Involucran
Procesos
Estudios toxicológicos
Pruebas biológicas
Síntesis química
Detección
Problemas de seguridad
del producto
Teratogenicidad
Carcinogenicidad
Componentes y procedimientos
esenciales en los ensayos clínicos
Análisis de datos
Incluye a todos/mayoría
de participantes aleatorizados
Análisis primario
Baja adherencia
Se excluye pacientes
Analiza pacientes como
parte del grupo original
Análisis por intención
de tratar
Medición de resultados
Metodos de enmascaramiento
Previene el sesgo de medición
Ciego de pacientes
Efecto Hawthorne
Efecto nocebo
Efecto placebo
Reclutamiento y aleatorización
de pacientes
Contol de sesgos
De confusión
De selección
Aspectos bioéticos y
registro del protocolo
Repositorios disponibles
ICTRP
OMS
Cochrane Central Register
of Controlled Trials
Cochrane
ISRCTN
Europa
Clinical Trials
USA
Declaración de Helsinki
Asociación Médica Mundial
1964
Conceptos preliminares
Cegamiento
(enmascaramiento)
Intervención
Fármaco
Principio activo
Placebo
Activos
Imitan a la
intervención
Pueden ser
Ciegos
Desconocen intervención
Triple ciego
Participante/investigador/evaluador
Doble ciego
Participante/investigador
Ciego simple
Participante desconoce
Abiertos
No ciegos
Conocen intervención
Participante
Investigador
Aleatorización
Método de control
Sesgos
Investigación
Control
Requiere
Dos grupos
Voluntarios sanos
Pacientes
Comparación
estadísticamente
válida
Entre
Medidas de asociación
Diseño prospectivo
Reducción relativa
de riesgo
Frecuente sobreestimación
Reportar RAR cuando
sea posible
Efectos del tratamiento
Aumento relativo del riesgo
Entre control (no expuestos)
RAR
Reducción absoluta
de riesgo (RAR)
Número necesario a tratar
Resultado negativo
Aumento absoluto de riesgo
Reducción de riesgo
Atribuida a intervención
Diferencia de riesgos
Grupo intervención
Grupo control
Riesgo Relativo
RR
Menor a 1
La intervención disminuye
la probabilidad del desenlace
Mayor a 1
La intervención aumenta
la probabilidad del
desenlace
Igual a 1
No existe asociación
Razón de los riesgos entre
No expuestos
Expuestos
Tipos de estudios
experimentales
en seres humanos
Estudios experimentales con
controles externos o históricos
Grupo control de diferente población
Estudios cuasi-experimentales
No presenta un proceso de aleatorización
Ensaro clínico aleatorizado clásico
Aleatoriza pacientes
que reciben una intervención