por Leonardo Baruk González Pozos hace 2 años
121
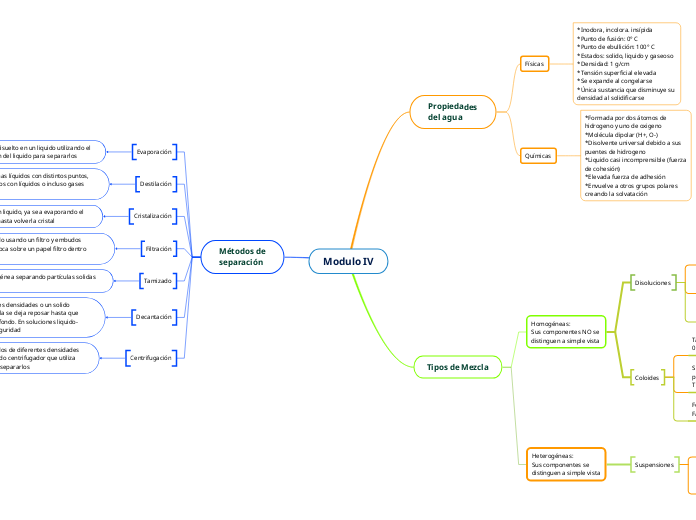
Modulo IV
Los métodos de separación de mezclas son técnicas esenciales en la química y otras ciencias. Entre ellos, se encuentra la evaporación, que utiliza el punto de ebullición de un líquido para separar un sólido disuelto.