por Laura Žarko hace 4 años
453
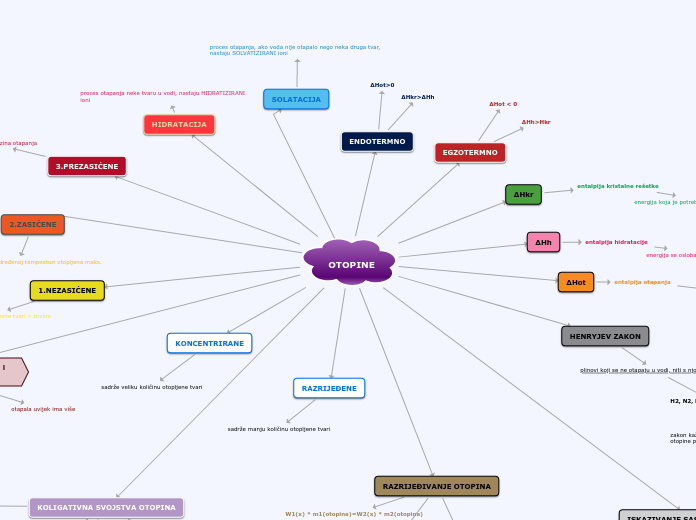
Organigram
Vztah mezi tlakem a rozpustností plynů v kapalinách je popsán Henryho zákonem, který uvádí, že rozpustnost plynu je přímo úměrná parciálnímu tlaku plynu nad kapalinou při dané teplotě.
por Laura Žarko hace 4 años
453

Ver más
HIPERTONIČNE OTOPINE - koje imaju vveći osmotski tlak od osmotskog tlaka promatrane otopine
HIPOTONIČNE OTOPINE - s manjim osmotskim tlakom od promatrane otopine
termodinamička temp. [K]
opća konst. 8.314JK-1 mol-1
množinska koncentracija [mol/dm3]
osmotski tlak [kPa]
tl(otopine)=tl(otapalo)-Δt
ΔT=Kf * b * i
KRIOSKOPSKA KONSTANTA OTAPALA [Kkg/mol]
razlika temp. [K]
tv(otopine)=tv(otapalo)+Δt
ΔT=Kb * b * i
broj čestica otopljene tvari
molalnost [mol/kg]
EBULIOSKOPSKA KOSTANTA OTAPALA [Kkg/mol]
razlika u temp. [K]
po porastu tlaka pare: Ca3(P4)2(s), MgCl2, NaCl, šećeri
što je veći broj čestica otopljene tvari tlak pare otapala je manji
RAULOV ZAKON
p=po + xo
množinski udio otapala xo=n(otapalo)/n(otopljene tvari) + n(otapalo)
X0<1
tlak pare otapala
tlak pare otopine [Pa]
NaCl (s) --H2O(l)--> Na+(aq) + Cl- i=2
MgCl2(s)--H20(l)--> Mg2+(aq) + 2Cl- i=3
Ca3(P4)2 (s)--H2O(l)--> 3Ca 2+(aq) + 2PO4 3-(aq) i=5
šećeri C6H12O6 (glukoza, fruktoza), C12H22O11 (saharoza) i=1
[mol/kg]
[mol/dm3]
ρ(otopine)=m(otopine)/v(otopine)
[g/dm3]
m(otopine)=(x)+m(otapala)
W(otapala)=m(otapala)/m(otopine)
[nema ili %]
zakon kaže da je topljivost plinova proporcionalna taku iznad otopine pri određenoj temperaturi
veći tlak - veća topljivost
ΔHkr > 0