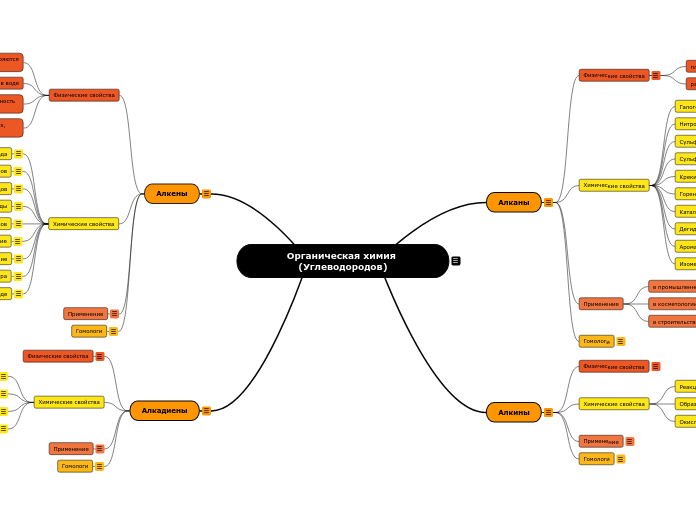
Органическая химия (Углеводородов)
Раздел химии, изучающий структуру, свойства и методы синтеза
углеводородов и их производных.
Алкадиены
класс углеводородов, содержащих две двойных связи углерод-углерод.
- пропадиен – С3Н4;
- бутадиен – С4Н6;
- пентадиен – С5Н8;
- гексадиен – С6Н10;
- гептадиен – С7Н12;
- октадиен – С8Н14;
- нонадиен – С9Н16;
- декадиен – С10Н18
Углеводороды, содержащие две и более двойные связи в молекуле – терпены – широко распространены в растительных организмах, часто обладают приятным запахом. Смеси терпенов используют в производстве духов и ароматических отдушек, а также в медицине.
Жизненно важен для человека b-каротин, который превращается в организме в витамин А, он содержится в красных и желтых плодах. Красный цвет b- каротина обусловлен длинной цепочкой сопряженных двойных связей.
Полимеризация
Реакция используется для получения искусственного каучука
nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n
Гидрогалогенирование
Присоединение галогеноводородов аналогично реакции с алканами. Реакция протекает в водной или спиртовой среде в присутствии хлорида лития
CH2=CH-CH=CH2 +HBr → CH3-CH(Br)-CH=CH2 или CH3-CH=CH-CH2-Br
Присоединение галогенов с образованием тетрагалогеноалканов
CH2=CH-CH=CH2 + Br2 → CH2(Br)-CH(Br)-CH=CH2 или CH2(Br)-CH=CH-CH2-Br
Гидрирование
Реакция протекает в присутствии катализатора – никеля
CH2=CH-CH=CH2 + 2H2 → CH3-CH2-CH2-CH3
При обычных условиях алкадиены имеют аналогичные с алкенами физические свойства. Простейшие представители ряда алкадиенов – пропадиен и бутадиен – бесцветные легко сжижаемые газы с неприятным запахом. Алкадиены, содержащие от пяти до 17 атомов углерода, а также их изомеры, являются жидкостями. Высшие диены с 18 и более атомами углерода – твёрдые вещества.
Подробнее:
https://obrazovaka.ru/himiya/alkadieny-obschaya-formula-10-klass.html
Алкены
ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n
- этен – C2H4;
- пропен – C3H6;
- бутен – C4H8;
- пентен – C5H10;
- гексен – C6H12;
- гептен – C7H14;
- октен – C8H16;
- нонен – C9H18;
- декен – C10H20
Основная область применения алкенов — получение полимеров. Из этилена и пропилена получают полиэтилен и полипропилен, из которых изготавливают самые разнообразные изделия, используемые в быту и промышленности.
Реакцией гидратации этилена получают этиловый спирт.
В результате присоединения хлора к этилену получают 1,2-дихлорэтан, который применяют в качестве растворителя.
Этилен ускоряет созревание различных плодов (груш, дынь, помидоров и т. д.). С целью лучшего сохранения плоды можно транспортировать неспелыми и доводить их до созревания на месте, вводя в воздух хранилищ этилен.
Кроме этого, алкены применяются для синтеза различных органических веществ.
Окисление кипящим перманганатом калия в кислой среде
Образуются карбоновые кислоты.
CH3-CH=CH-CH3 + 4[O] → 2CH3COOH
Реакция Вагнера
Окисление перманганатом калия в щелочной или нейтральной среде. Образуются спирты.
3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2OH-CH2OH + 2KOH + 2MnO2
Неполное окисление
Протекает в присутствии катализатора. Алкен, смешанный с кислородом, пропускают над нагретым серебром. Образуется эпоксид – оксид алкена.
2CH2=CH2 + O2 → 2CH2-O-CH2
Протекает при избытке кислорода.
CH2=CH2 + 3O2 → 2CO2 + H2O
Полимеризация – увеличение числа атомов
Протекает в присутствии катализатора, при повышенных давлении и температуре. Таким способом получают полиэтилен, поливинилхлорид, полипропилен.
nCH2=CH2 → (-CH2-CH2-)n
Гидратация – присоединение воды
Реакция протекает в присутствии неорганических кислот – серной, фосфорной. Выполняют функцию катализатора и являются источниками водорода. Образуются одноатомные спирты.
CH2=CH2 + H2O → CH3-CH2OH
Гидрогалогенирование – присоединение галогеноводородов
Реакция электрофильного присоединения. Электрофилом является протон водорода в составе галогена. Образуются галогеналканы.
CH2=CH2 + HCl → CH3-CH2-Cl (хлорэтан)
Галогенирование – присоединение галогенов
Протекает при обычных условиях. Галогены присоединяются по двойной связи. Образуются дигалогеналканы.
– CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl (1,2-дихлорэтан);
– CH3-CH=CH-CH3 + Br2 → CH3-CH-Br-CH-Br-CH3 (2,3-дибромбутан)
Гидрирование – присоединение водорода
Протекает при высоком давлении в присутствии катализатора – никеля, палладия или платины. Образуются алканы – предельные углеводороды.
CH2=CH-CH3 + H2 → CH3-CH2-CH3
растворяются в органических растворителях – спиртах, эфирах.
держатся на водной поверхности, так как имеют плотность во много раз меньше плотности воды
не растворяются в воде
практически нерастворимы в воде, но хорошо растворяются в органических растворителях.
Алкины
ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле СпН2n-2. Атомы углерода, между которыми образована тройная связь, находятся в состоянии sр — гибридизации.
- ацетилен – C2H2;
- пропин – C3H4;
- бутин – C4H6;
- пентин – C5H8;
- гексин – C6H10;
- гептин – C7H12;
- октин – C8H14;
- нонин – C9H16;
- декин – C10H18
Основные направления применения алкинов - органический синтез, сырье для производства синтетических каучуков и других полимеров, сварка и резка металлов
Окисление
Образование солей
Реакции присоединения
1.Гидрирование
Гидрирование алкинов протекает в тех же условиях, что гидрирование алкенов. В зависимости от количества водорода может образоваться алкен или алкан.


2. Галогенирование.
Обесцвечивание бромной воды – качественная реакция на алкины, так же как на алкены.


3. Гидрогалогенирование.
Присоединение хлороводорода к ацетилену приводит к образованию винилхлорида (хлорэтена) – мономера для синтеза распространенного материала поливинилхлорида (ПВХ):
 ,
,
4. Гидратация (реакция Кучерова)
Реакция проходит в кислой среде в присутствии солей ртути. Образующийся на первой стадии енол перегруппировывается в карбонильное соединение.


Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы.
При обычных условиях алкины С2Н2 — С4Н6 – газы, С5Н8 — С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов.Алкины плохо растворимы в воде, лучше – в органических растворителях.
Алканы
ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Гомологи
- метан – CH4;
- этан – C2H6;
- пропан – C3H8;
- бутан – C4H10;
- пентан – C5H12;
- гексан – C6H14;
- гептан – C7H16;
- октан – C8H18;
- нонан – C9H20;
- декан – C10H22
Применение
в строительстве
в косметологии
в промышленной химии
Химические свойства
Изомеризация
Образование изомеров под действием температуры и катализаторов.
C5H12 → CH3-CH(CH3)-CH2-CH3
Ароматизация
Реакция дегидрирования с образованием циклоалканов.
C6H14 → C6H6 + 4H2
Дегидрирование
Отщепление водорода в результате разрыва связей С-Н в присутствии катализатора (платины, оксида алюминия, оксида хрома) при температуре 400-600°С. Образуются алкены.
C2H6 → C2H4 + H2
Каталитическое окисление
Происходит частичное окисление алканов при небольшой температуре и в присутствии катализаторов. Могут образовываться кетоны, альдегиды, спирты, карбоновые кислоты.
C4H10 → 2CH3COOH + H2O
Горение
В избытке кислорода происходит полное окисление до углекислого газа. При недостатке кислорода происходит неполное окисление с образованием угарного газа, сажи.
CH4 + 2O2 → CO2 + 2H2O;
– 2CH4 + 3O2 → 2CO + 4H2O
Крекинг
Происходит в присутствии катализатора при высоких температурах. В результате разрыва связей С-С образуются алканы и алкены.
C4H10 → C2H6 + C2H4
Сульфоокисление
Образование алкансульфоновых кислот в избытке кислорода. Атом водорода замещается группой SO3H.
C5H10 + HOSO3H → C5H11SO3H + H2O
Сульфохлорирование
Сопровождается окислением с образованием алкансульфонилхлоридов.
R-H + SO2 + Cl2 → R-SO3Cl + HCl
Нитрование (реакция Коновалова)
Взаимодействие с разбавленной азотной кислотой при температуре 140°C. Атом водорода замещается нитрогруппой NO2. В результате образуются нитроалканы.
CH3-CH3 +HNO3 → CH3-CH2-NO2 + H2O
Галогенирование
Реагируют с F2, Cl2, Br2. Реакция с йодом не идёт. Галогены замещают атом водорода. Реакция с фтором сопровождается взрывом. Хлорирование и бромирование происходит при температуре 300-400°C. В результате образуются галогеналканы.
CH4 + Cl2 → CH3Cl + HCl
Физические свойства
Все вещества, содержащие больше 15 атомов углерода, являются твёрдыми соединениями. Чем больше содержится в молекуле атомов углерода, тем выше температуры плавления и кипения. Однако чем меньше разветвлён изомер, тем выше его температуры плавления и кипения, поэтому разветвлённые изомеры кипят при более низких температурах, чем линейные аналоги.
Подробнее:
https://obrazovaka.ru/himiya/fizicheskie-svoystva-alkanov-kratko.html
растворяются в органических растворителях
плохо растворимы в воде