RESPUESTAS INNATAS DEL HOSPEDADOR
PUENTE HASTA LAS RESPUESTAS INMUNITARIAS ESPECIFICAS FRENTE ANTIGENOS
INFLAMACION
RESPUESTAS ASOCIADAS A LA MICROBIOTA NORMAL
ACTIVACION DE RESPUESTAS CELULARES INNATAS
COMPONENTES CELULARES DE LAS RESPUESTAS INNATAS
LINFOCITOS CITOLÍCOS ESPONTÁNEOS, LINFOCITOS T G/D Y LINFOCITOS NKT
Los linfocitos NKT y los linfocitos T g/d residen en los tejidos y en la sangre y difieren de los otros linfocitos T en que tienen un repertorio limitado de receptores del linfocito T. Ademas los NKT y T g/d detectan antígenos no peptídicos, como los glucolípidos bacterianos (micobacterias) y los metabolitos amino fosforilados.
LINFOCITOS NK
Expresan marcadores de superficie celular de los linfocitos T (p. ej., CD2, CD7, receptor para la IL-2 [IL-2R] y FasL. Los linfocitos NK activados producen IFN-g, IL-1 y factor estimulante de colonias de granulocitos y macrófagos (GM-CSF).
Los linfocitos NK se activan con 1) IFN-a e IFN-b, 2) TNF-a, 3) IL-12, IL-15 e IL-18 y 4) IL-2.
No expresan un receptor del linfocito T ni CD3 y no pueden producir IL-2. No reconocen ningún antígeno específico ni requieren la presentación del antígeno por las moléculas del MHC.
Son linfocitos granulares grandes (LGL), comparten características con los linfocitos T-
Son responsables de la citotoxicidad celular dependiente de anticuerpos (CCDA) en la que se unen a células cubiertas de anticuerpos y las matan.
Son células linfocíticas innatas (ILC) que proporcionan una respuesta celular temprana a la infección vírica, tienen actividad antitumoral y amplifican las reacciones inflamatorias después de la infección bacteriana.
CELULAS DENTRITICAS Y CELULAS DENTRITICAS INMADURAS
CELULAS DENTRITICAS INMADURAS
Las CDi son fagocíticas y tras activarse con las señales de peligro liberan un sistema de alarma temprano mediado por citocinas y después maduran en CD. Las CD maduras son la última célula presentadora de antígeno.
CELULAS DENTRITICAS
Constituyen un puente entre las respuestas inmunitarias innatas y las adaptativas. Los monocitos y los precursores de las CD mielocíticas circulan en la sangre y después se diferencian en CDi en el tejido y los órganos linfáticos.
CELULAS DE LINAJE MONOCITO-MACROFAGICO
MACROFAGOS M2: Los macrófagos activados de forma alternativa (macrófagos M2) se activan gracias a las citocinas relacionadas con los TH2, IL-4 e IL-13, y apoyan las respuestas antiparasitarias, promueven la reestructuración de los tejidos y fomentan la reparación de la herida.
MACROFAGOS M1: Los macrófagos pueden activarse con IFN-g (activación clásica) producido por los linfocitos NK y los linfocitos T CD4 y CD8 como parte de la respuesta TH1 y entonces son capaces de matar a las bacterias fagocitadas. A éstos se les llama macrófagos M1.
Los macrófagos deben activarse para matar a los microbios fagocitados, pueden dividirse y permanecen en la zona de infección o inflamación.
Los macrófagos maduran a partir de los monocitos sanguíneos y, están decorados con receptores para opsoninas con el fin de promover la fagocitosis de los microbios.
FAGOCITOS
Los neutrófilos tienen una función de protecciones antibacteriana y antimicótica y una menor en las protecciones antivíricas, su superficie está decorada con receptores que se unen a los microbios, que promueven la fagocitosis del microbio y su posterior lisis.
COMPONENTES SOLUBLES DE LAS RESPUESTAS INNATAS
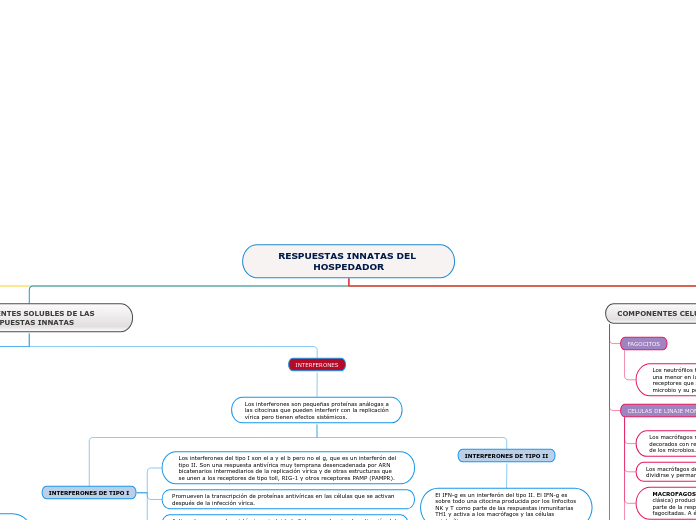
INTERFERONES
Los interferones son pequeñas proteínas análogas a las citocinas que pueden interferir con la replicación vírica pero tienen efectos sistémicos.
INTERFERONES DE TIPO II
El IFN-g es un interferón del tipo II. El IFN-g es sobre todo una citocina producida por los linfocitos NK y T como parte de las respuestas inmunitarias TH1 y activa a los macrófagos y las células mielocíticas.
INTERFERONES DE TIPO I
Activan las respuestas sistémicas, incluida la fiebre, y potencian la activación del linfocito T.
Promueven la transcripción de proteínas antivíricas en las células que se activan después de la infección vírica.
Los interferones del tipo I son el a y el b pero no el g, que es un interferón del tipo II. Son una respuesta antivírica muy temprana desencadenada por ARN bicatenarios intermediarios de la replicación vírica y de otras estructuras que se unen a los receptores de tipo toll, RIG-1 y otros receptores PAMP (PAMPR).
COMPLEMENTOS
Regulación de la activación del complemento
Los seres humanos tienen varios mecanismos para impedir la generación de la C3-convertasa con el fin de protegerse frente a una activación inadecuada del complemento. Entre ellos están el inhibidor del C1, la proteína ligadora del C4, el factor H, el factor I y proteínas de la superficie celular, y la proteína cofactor de membrana.
Complejo de ataque de la membrana
En la última fase de la vía clásica se crea el complejo de ataque de la membrana (MAC), que también se llama unidad lítica. Las cinco últimas proteínas del complemento (C5 a C9) se ensamblan en un MAC en las membranas celulares diana para mediar la lesión.
Actividades biológicas de los componentes del complemento
El sistema del complemento también interactúa con la cascada de la coagulación. Los factores de la coagulación activados pueden escindir al C5a y una proteasa de la vía de la lectina puede escindir la protrombina para producir fibrina y activar la cascada de la coagulación.
Los fragmentos del complemento C3a, C4a y C5a actúan como poderosas anafilotoxinas. El C3a y el C5a actúan como sustancias que atraen (factores quimiotácticos) a neutrófilos y macrófagos.
Estas proteínas son promotores poderosos de las reacciones inflamatorias. Constituyen la principal función antimicrobiana del sistema del complemento.
El C3b es una opsonina que promueve la eliminación de bacterias.
El C3b puede sufrir una escisión adicional para generar C3d, que es un activador de los linfocitos B.
La escisión de los componentes C3 y C5 produce factores que potencian la eliminación del microorganismo infeccioso al promover el acceso a la zona de infección y atraer a las células que median las reacciones inflamatorias protectoras.
El sistema del complemento es una alarma y un arma contra la infección, especialmente la infección bacteriana.
Las tres vías de activación del complemento se unen en un punto de unión omún, la activación del componente C3.
VÍA CLASICA
La cascada del complemento clásica la inicia la unión del primer componente, C1, a la porción Fc del anticuerpo (IgG o IgM, no IgA ni IgE) que se une a antígenos de la superficie celular o a un inmunocomplejo con antígenos solubles.
VÍA DE LA LECTINA
Es un mecanismo de defensa frente a bacterias y hongos. La proteína ligadora de manosa es una proteína sérica grande que se une a la manosa sin reducir, la fucosa y la glucosamina situadas en las superficies bacterianas, micóticas y de otras células.
VÍA ALTERNATIVA
La vía alternativa se activa directamente por las superficies bacterianas y sus componentes (p. ej., endotoxina, polisacáridos microbianos), así como por otros factores. La activación está mediada por la unión de la properdina factor B al C3b y después con la properdina factor D, que escinde al factor B en el complejo para dar lugar al fragmento activo Bb que permanece unido al C3b (unidad de activación).
La activación por cualquier vía inicia una cascada de acontecimientos proteolíticos que escinde a las proteínas en las subunidades «a» y «b».
Al sistema del complemento lo activan directamente las bacterias y los productos bacterianos, la unión de la lectina a azúcares situados en la superficie de la célula bacteriana (proteína ligadora de manosa) o los complejos de anticuerpo y antígeno.
PEPTIDOS ANTIMICROBIANOS
Las defensinas y las catelicidinas son péptidos producidos por los neutrófilos, las células epiteliales y otras células que son tóxicas para muchos microbios.
Las DEFENSINAS son péptidos catiónicos pequeños (aproximadamente 30 aminoácidos)
que pueden romper las membranas, matar a las bacterias y los hongos e inactivar a los virus.
Las CATELICIDINAS se escinden para producir péptidos microbicidas
BARRERAS DE LA INFECCION
Los ácidos grasos libres, el ácido láctico de la sudoración, el pH bajo y el ambiente relativamente seco de la piel son condiciones desfavorables para la supervivencia de la mayoría de los microorganismos.
Las sustancias antimicrobianas (peptidos catiónicos [defensinas], lisozima, lactoferrina e IgA secretoria) que se encuentran en las superficies mucosas (p. ej., lagrimas, moco y saliva) tambien proporcionan proteccion.
La piel y las mucosas sirven de barrera a la mayoría de los microorganismos infecciosos.
Epitelio de la mucosa que cubre los orificios del cuerpo esta protegido por secreciones de moco y cilios.