によって Juana Jaramillo 4年前.
1362
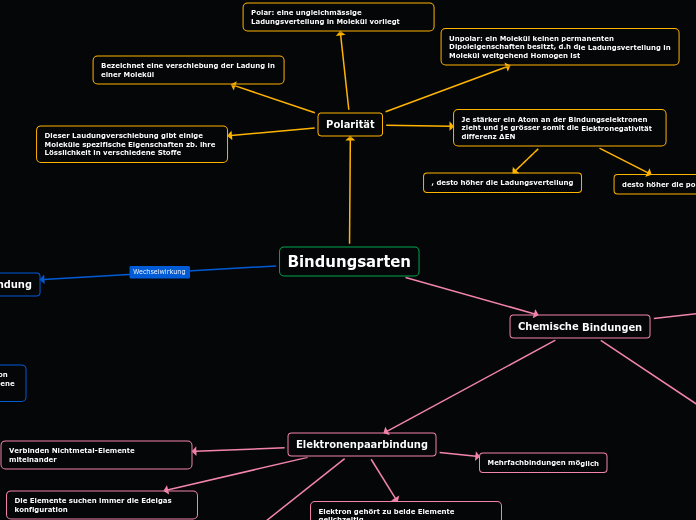
Bindungsarten
Die verschiedenen chemischen Bindungsarten spielen eine wichtige Rolle in der Chemie. Van-der-Waals-Kräfte sind schwache intermolekulare Kräfte, die auch bei unpolaren Molekülen wirken und die physikalischen Eigenschaften beeinflussen.