by Lucas Calloni 4 years ago
408
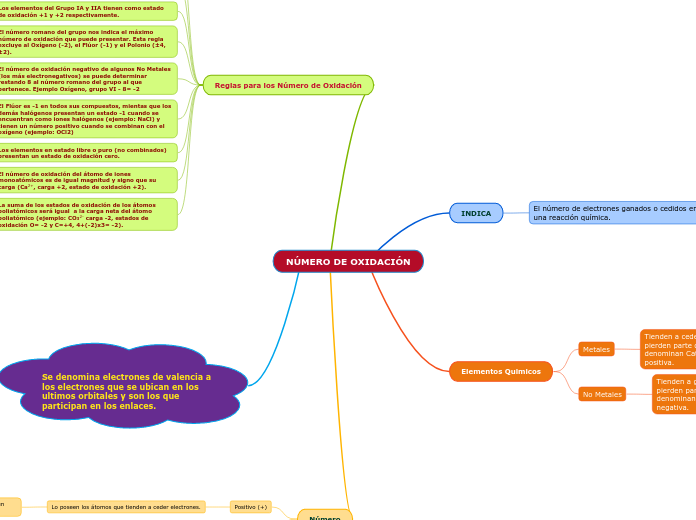
NÚMERO DE OXIDACIÓN1
by Lucas Calloni 4 years ago
408

More like this
Se da en No Metales mayormente y/o cuando se forma un enlace con un átomo menos electronegativo que este.
Se da en Metales o Semimetales y/o cuando se forma un enlace con un átomo más electronegativo que este.
Se denota: Anión + elemento + un super indice con la cantidad de electrones ganados y el símbolo -
Ejemplo: Anión Cloro-
Se denota: Catión + elemento + un superindice con la cantidad de electrones cedidos y el símbolo +
Ejemplo: Catión Sodio+