Diagrama de bloques
Ejercicio 2
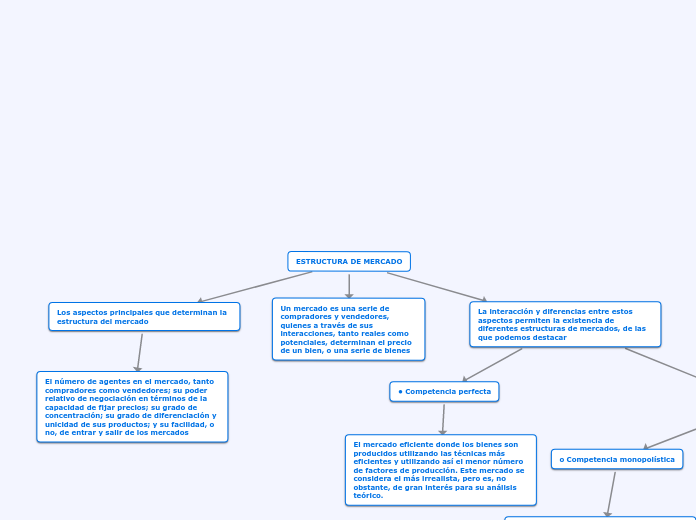
¿Como preparia una solucion reguladora de pH igual a 9, diga los reactivos, a que concentracion se preapararia y como lo prepararian?
Paso 1: Analizar el problema y el pH que es necesario para la solucion amortiguadora
Paso 2: Busacar en las tablas de pKa que en este caso sera el amonio y amoniaco, con un Pka de 9.25 (NH4 y NH3).
Paso 3: Sabiendo esto, debemos de considerar la concentracion de la solucionn a la que va estar preparada dicha solucion. En este caso sera a 0.1 M
Paso 4: Ir vertiendo poco a poco el acido fuerte (Amonio NH4) en una solucion hasta llegar al PH desiado, que nos lo representara un electrodo
Ejercicio 1
Se requiere preparar una solucion de acido flourhidrico de concentracion 0.1 M en 250 mL de solucion, 1.15 g/cm3 es la densidad, cuyo porciento de pureza es de 60% determine el volumen de acido flourhidrico al 60% porciento de pureza que se requiere para dicha solucion.
Paso 2: Plantear las formulas para poder determinar lo que se pide.
M= g(soluto)/(PM)*(Volumen en litros)
ρ=masa/volumen
pka=-logka
x2+kax-kaco=0
pH=-log[H30]
Calcular pH de la solucion
Paso 1: Calcular la constante de acidez para realizar calculos.
pka=-logka
Sustitucion:
3.16= -logka
1/10pka= ka
1/10^3.16=ka
ka=6.91x10^-9
Paso 2: Realizar los calculos correspondientes para los iones hidronio.
x^2+Kax-KaCo=0
Susticion:
1^2+(6.91x10-9)-(6.91x10-4)(0.1)
Utilizar la formula genral para seguir con el procedimiento
[H3O]= 7.97x10^-3
Paso 3: Por ultimo, con los iones hidronio sacar el pH de la solucion.
pH=-log[H3O]
Sustitucion:
pH=-log[7.97x10-3]
pH=2.0985
Volumen de acido flourhidrico
Paso 1: Encontrar los gramos de acido flourhidrico en solucion.
M=g(soluto)/(PM)*(Volumen en litros)
Sustitucion:
0.1=x/20(g/mol)*(0.250L)
20(g/mol)*(0.250L)*(0.1)= 0.5g de HF
Paso 2: Agregar las impurezas correspondientes a la pureza de 60%.
0.5----->60%
x------->100%
Sustitucion:
x------->100%
X=0.833
Paso 3: Con la masa calculada en el anterior paso, sacar el volumen correspondiente al acido flourhidrico.
ρ=masa/volumen
Sustitucion:
1.15 (g/cm3)=(0.7243 g HF)/(volumen x)
1.15 (g/cm3)/(0.7243 g HF)= (volumen x)
Volumen= 0.7243 mL
Paso 1: Observar el ejercicio y anotar los datos correspondientes.
Concentracion de solucion: 0.1M
Volumen de la solucion: 250 mL
Densidad de la solucion: 1.15 g/cm3
Porciento de pureza: 60%
Determinar el volumen de acido flourhidrico