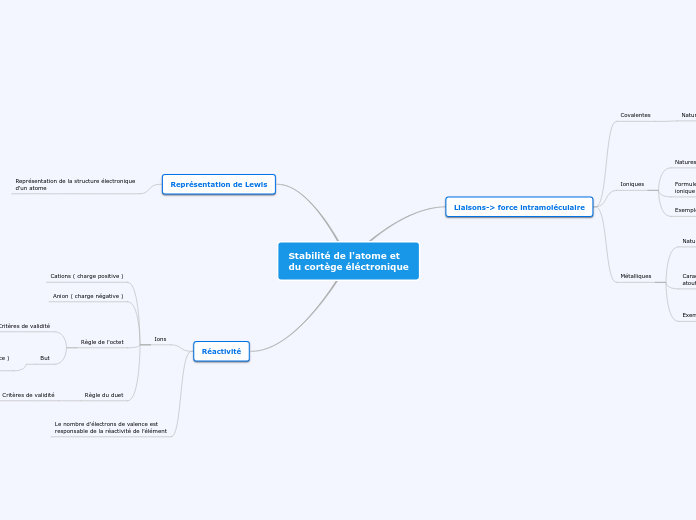
Stabilité de l'atome et
du cortège éléctronique
Réactivité
Le nombre d'électrons de valence est
responsable de la réactivité de l’élément
Ions
Règle du duet
On dit que le duet est satisfait si :
Si un atome a 2 électrons de valence
dans sa couche externe
Règle de l'octet
But
Avoir une configuration électronique
d'un gaz noble ( 8 électrons de valence )
pour être inerte chimiquement.
Critères de validité
On dit que l'octet est satisfait si :
Si un atome a 8 électrons de valence
dans sa couche externe
Anion ( charge négative )
Cations ( charge positive )
Représentation de Lewis
Représentation de la structure électronique
d'un atome
Liaisons-> force intramoléculaire
Métalliques
H-F ( représentation de Lewis )
Caractéristiques et
atouts
Brillants
Malléables
Ductiles
Conduisent la chaleur
Conduisent l'électricité
Plus faible que les deux autres liaisons
Ions solides combinés dans les solides de cristallin
avec des électrons de valence mobiles libres.
Libres de bougés car si un s'éloigne
un autre prend sa place
Ioniques
Na+Cl-
Formule d'un composé
ionique neutre
Total des charges positives des cations = Total des charges négatives des anions
Natures des liaisons
Attraction électrostatiques entre deux ions
de charges opposé
Covalentes
Nature des liaisons
Exemple
CO2 -> O=C=O ( représentation de Lewis )
Atomes liées en partageant électrons de
valence pour avoir un configuration
électronique identique à celles des gaz nobles
Liaisons stables