por Luis Ernesto Gómez Sandoval 3 anos atrás
384
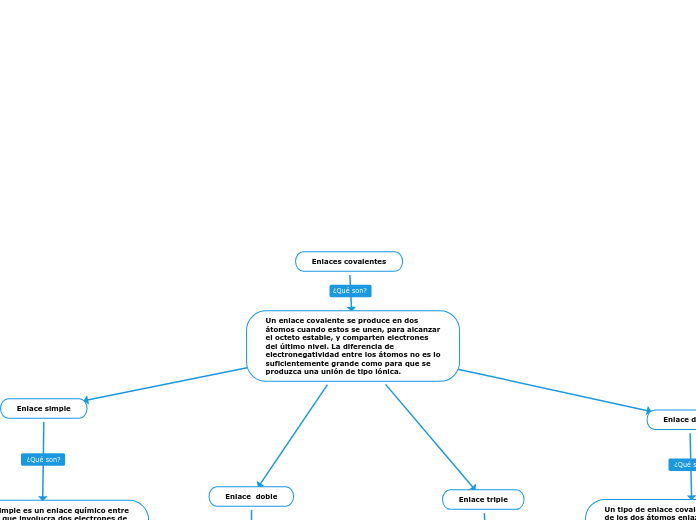
Enlaces covalentes
Los enlaces covalentes se forman cuando dos átomos comparten electrones para alcanzar una configuración estable, siendo la diferencia de electronegatividad entre ellos insuficiente para crear un enlace iónico.