por Gabriela Sgroi 4 anos atrás
276
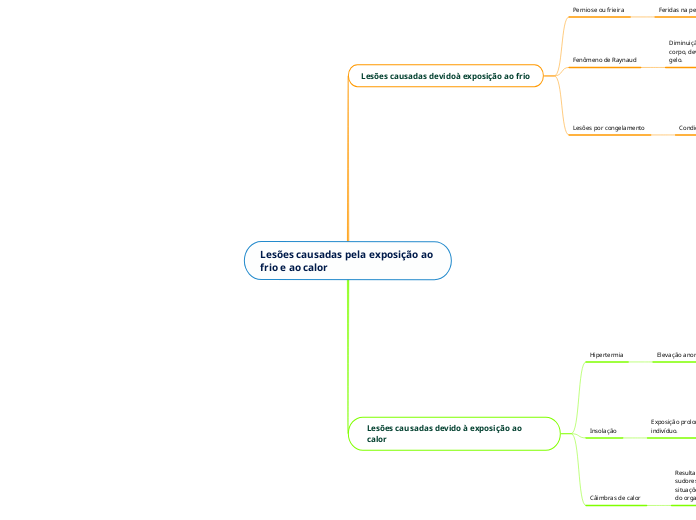
Organigrama em árvore
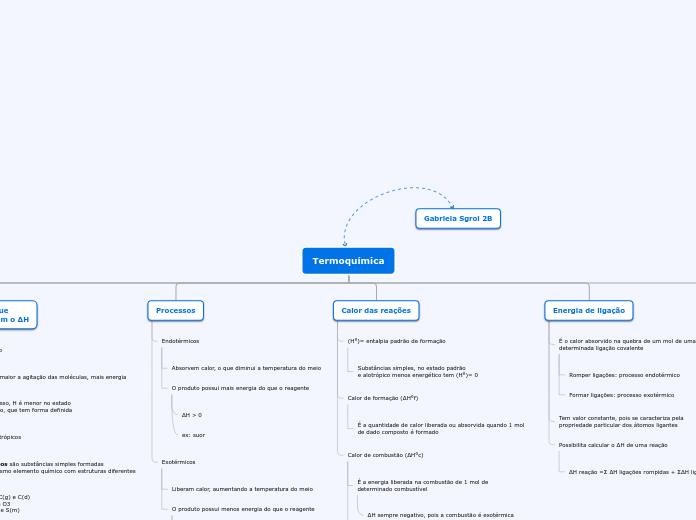
A termoquímica é um ramo da química que estuda as mudanças de energia associadas às reações químicas, focando principalmente na entalpia (H). Reações exotérmicas liberam calor, resultando em produtos com menos energia do que os reagentes, enquanto reações endotérmicas absorvem calor, formando produtos com mais energia.