jonka Elisa Johanna Chaparro Chaves 3 vuotta sitten
253
Organigrama arbol
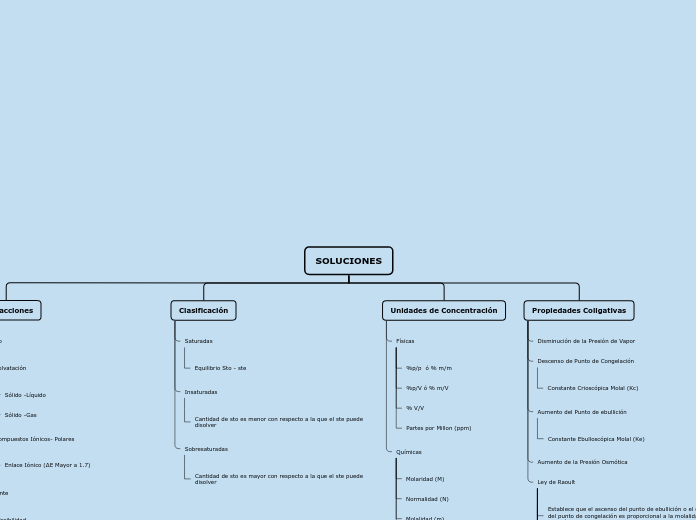
El documento aborda diversos conceptos y unidades de concentración química, como molalidad, fracción molar, molaridad y normalidad. También se exploran las propiedades coligativas, tales como el aumento de la presión osmótica, la disminución de la presión de vapor y el aumento del punto de ebullición, relacionadas con la molalidad de la solución.